As multifaces das goticulas lipidicas: essas organelas desempenham funcao primaria mediante estimulo inflamatorio em macrofagos
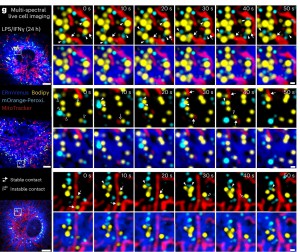
Legenda: a, Os macrófagos reorganizam seu interatoma de gotículas lipídicas (LD) em resposta a estímulos inflamatórios, montando seletivamente unidades Mitochondria-Endoplasmic Reticulum-Peroxisome-LD (M–ER–P–LD). A dinâmica das interações entre mitocôndrias–LD (setas) e peroxissomos–LD (cabeças de seta) em macrófagos derivados da medula óssea (BMDMs) tratados com LPS/IFNγ por 24 horas é mostrada. As interações estáveis são indicadas com setas preenchidas, enquanto as interações instáveis são mostradas com setas vazias ou cabeças de seta. As imagens representam planos z únicos de confocal de n = 3 repetições biológicas. Barras de escala: 5 µm (esquerda) e 0,5 µm (direita).
Creditos da imagem: Zimmermann et al, 2024
Neste recente trabalho publicado na Nature Cell Biology por Zimmermann et al, na busca para entender como as células coordenam processos metabólicos complexos, os pesquisadores se concentraram nos macrófagos, um tipo de célula imune que ajusta suas atividades metabólicas em resposta à inflamação. O metabolismo lipídico, um aspecto crucial da função celular, envolve múltiplos organelos: gotículas lipídicas (LDs), mitocôndrias, peroxissomos, lisossomos e o retículo endoplasmático (RE). Esses organelos precisam interagir dinamicamente para regular o metabolismo lipídico, mas entender sua coordenação simultânea tem sido desafiador.
Uma técnica inovadora de imagem chamada OrgaPlexing foi desenvolvida para abordar essa questão. Esse método permite a visualização e análise simultânea de até seis organelos em macrófagos. Usando o OrgaPlexing, os pesquisadores observaram como os macrófagos derivados da medula óssea (BMDMs) respondem a estímulos bacterianos e inflamatórios, como Staphylococcus aureus aquecido ou lipopolissacarídeo (LPS) com interferon-gama (IFNγ). A abordagem possibilitou o rastreamento detalhado da dinâmica dos organelos, incluindo mudanças em sua posição, volume e interações.
Os resultados revelaram que a ativação dos macrófagos leva a uma remodelação significativa da arquitetura dos organelos. Por exemplo, as gotículas lipídicas se acumulam e interagem com outros organelos, formando aglomerados que incluem mitocôndrias, RE e peroxissomos. Esses aglomerados, particularmente as unidades mitocôndria–RE–peroxissomo–LD (M–RE–P–LD), são cruciais para a resposta inflamatória. O estudo demonstrou que esses organelos trabalham juntos para gerenciar o tráfego e armazenamento de ácidos graxos, influenciando o metabolismo lipídico e a produção de prostaglandina E2 (PGE2), um mediador inflamatório chave.
A pesquisa também identificou proteínas específicas envolvidas na ancoragem dos organelos. MIGA2, por exemplo, foi encontrado como um papel crítico na formação de aglomerados M–RE–LD e no aumento do metabolismo lipídico e da produção de PGE2. Em contraste, mutações que afetam a função de MIGA2 ou outras proteínas-chave levaram à formação desorganizada dos aglomerados e à redução da produção de PGE2.
Além disso, o estudo descobriu o papel do regulador da fissão mitocondrial DRP1 na modulação das interações entre organelos e na síntese de PGE2. A deficiência de DRP1 resultou em alteração do agrupamento dos organelos e aumento da produção de PGE2. Por outro lado, a atuação sobre a função peroxissomal, particularmente pela depleção de PEX5 ou ABCD1, também afetou a dinâmica lipídica e a síntese de PGE2.
Em resumo, esta pesquisa destaca a intricada rede de interações entre organelos nos macrófagos durante as respostas inflamatórias. A capacidade de visualizar e analisar múltiplos organelos simultaneamente proporcionou insights valiosos sobre suas funções coordenadas, revelando jogadores-chave no metabolismo lipídico e na inflamação.
Functional multi-organelle units control inflammatory lipid metabolism of macrophages
Functional multi-organelle units control inflammatory lipid metabolism of macrophages