Navegando pela Confinamento: O Papel dos Microtúbulos na Migração Celular
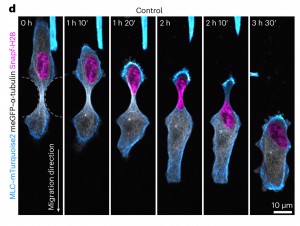
Legenda: Imagens em timelapse de células 1205Lu controle com microtúbulos marcados fluorescentemente (meGFP–α-tubulina), núcleo (SNAP-tag–H2B–JF549) e cadeia leve de miosina (MYL9, MLC–mTurquoise2) durante migração em espaços confinados
Crédito das imagens: Ju et al, 2024
No mundo agitado e lotado da célula, cada movimento microscópico conta. As células frequentemente se encontram navegando por espaços estreitos, se espremendo através de poros na matriz, serpenteando ao longo de trilhas teciduais ou deslizando por lacunas intercelulares. Esses ambientes confinados apresentam desafios mecânicos formidáveis. No coração dessa luta está o núcleo celular, o organelo maior e mais rígido. Para que uma célula migre com sucesso através desses espaços apertados, ela deve gerenciar habilmente a posição do núcleo e protegê-lo enquanto orquestra as forças contráteis do citoesqueleto da célula.
Pesquisas recentes lançam luz sobre um componente crucial desse quebra-cabeça migratório: os microtúbulos. Esses elementos estruturais, parte do andaime interno da célula, desempenham um papel fundamental na navegação por espaços tridimensionais (3D) confinados. Embora saibamos que os microtúbulos são essenciais para a migração, os detalhes de sua participação nesse processo permaneciam elusivos. Acontece que seu comportamento em espaços confinados não se trata apenas de suporte estrutural, mas também de adaptação dinâmica e reparo em resposta ao estresse mecânico.
No laboratório, os cientistas usaram técnicas avançadas de imagem, como a microscopia de fluorescência em luz de lâmina (LSFM), para observar microtúbulos em células de melanoma altamente migratórias imersas em hidrogéis de colágeno. Esses experimentos revelaram que microtúbulos nesses ambientes 3D formam uma estrutura dinâmica e semelhante a uma gaiola ao redor do núcleo. Essa gaiola se adapta continuamente à medida que a célula se move por constrições, com os microtúbulos se acumulando em pontos de estresse mecânico elevado. A alta curvatura desses microtúbulos os torna suscetíveis a danos, levando os cientistas a hipotetizar que sua manutenção depende de mecanismos de reparo sofisticados.
Um dos principais atores nesse processo de reparo é uma família de proteínas conhecida como Proteínas Associadas ao Ligador Citoplasmático (CLASPs). Essas proteínas atuam como fatores de resgate para os microtúbulos, ajudando a estabilizá-los e repará-los quando sofrem danos. Em experimentos onde as CLASPs foram esgotadas, as células lutaram para migrar através de espaços estreitos e frequentemente se romperam, destacando o papel crítico das CLASPs na manutenção da estabilidade dos microtúbulos sob estresse mecânico.
Quando as células foram submetidas a confinamento em canais microfabricados ou hidrogéis de colágeno, as células com deficiência de CLASP apresentaram defeitos significativos. Elas falharam em formar uma almofada estável de microtúbulos—uma estrutura que normalmente protege e suporta o núcleo durante a constrição. Essa almofada, rica em tubulina acetilada, serve como uma barreira protetora contra as contrações corticais traseiras e as forças compressivas do citoplasma. Sem ela, o núcleo não podia ser posicionado adequadamente, levando a um aumento das instâncias de ruptura nuclear e morte celular.
Além disso, as células sem CLASP exibiram blebs corticais anormais e persistentes—projeções da membrana resultantes de uma falha em manter o equilíbrio adequado de pressão hidrostática e contratilidade. Esse blebbing era mais pronunciado e persistente em comparação com as células controle, sugerindo uma falha na coordenação das forças mecânicas necessárias para uma migração eficaz.
No cerne desse problema está a interação entre microtúbulos e contratilidade do actomiosina, que rege como as células respondem às forças mecânicas. As CLASPs, por meio de suas propriedades mecano-responsivas, desempenham um papel crucial na regulação dessa interação. Elas ajudam a estabilizar os microtúbulos em resposta a forças compressivas, garantindo o tempo e a localização adequados dos sinais contráteis dentro da célula. Em uma observação marcante, a ausência de CLASPs levou a uma falha em concentrar reguladores chave da contratilidade, como GEF-H1, na parte traseira da célula. Essa disrupção resultou em contratilidade descoordenada e migração não produtiva.
Para entender melhor essas dinâmicas, os cientistas desenvolveram um modelo matemático que simula as forças em jogo durante a migração celular através de espaços confinados. Esse modelo destaca como o reforço mecânico dos microtúbulos pelas CLASPs ajuda a equilibrar as pressões internas e facilita a translocação nuclear eficiente. Quando a almofada de microtúbulos é comprometida, a célula luta para manter o equilíbrio de pressão, levando a uma migração ineficiente e a uma potencial ruptura celular.
Em resumo, os microtúbulos são mais do que apenas elementos estruturais; eles são componentes dinâmicos e mecano-responsivos essenciais para navegar por espaços confinados. As CLASPs, ao reforçar e estabilizar os microtúbulos em resposta ao estresse mecânico, desempenham um papel crucial em garantir que as células possam migrar efetivamente através de ambientes desafiadores. Esse entendimento do mecanostato dos microtúbulos—um mecanismo de feedback que ajuda as células a se adaptarem aos desafios mecânicos—abre novas avenidas para explorar a mecânica celular e, potencialmente, desenvolver intervenções para doenças onde a migração celular está comprometida.
Compression-dependent microtubule reinforcement enables cells to navigate confined environments
Compression-dependent microtubule reinforcement enables cells to navigate confined environments