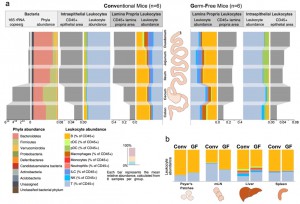
A Interação Segmentar entre Microbiota e Células Imunes no Intestino Murino
Legenda: Visão geral da colonização bacteriana segmentar e das células imunes associadas no intestino de camundongos. As abundâncias de bactérias e células imunes foram mostradas para os cinco segmentos intestinais indicados: Placas de Peyer, linfonodos mesentéricos, fígado e baço.(a) Ilustração das quantidades absolutas (cinza) e relativas (coloridas) de bactérias intestinais, da lâmina própria e de leucócitos intraepiteliais ao longo dos cinco segmentos intestinais de camundongos convencionais (CONV, à esquerda) ou livres de germes (GF, à direita). Os táxons bacterianos foram mostrados no nível de filo, conforme avaliado por sequenciamento metagenômico. A quantificação absoluta dos leucócitos intraepiteliais (IEL) e da lâmina própria (LPL) foi realizada por imunofluorescência de CD45+. A quantificação relativa de subpopulações amplas de leucócitos foi feita por citometria de fluxo.(b) Composição das células imunes das Placas de Peyer e linfonodos mesentéricos, órgãos associados ao intestino, o baço como órgão linfático sistêmico, e o fígado como órgão portal venoso central. Citometria de fluxo. CONV – camundongos convencionais, GF – livres de germes, mLNs – linfonodos mesentéricos, PP – Placas de Peyer.
Creditos da imagem: Anandakumar et al, 2024
A pesquisa publicada recentemente na revista *Gut Microbes* oferece novos insights sobre como diferentes regiões do trato intestinal murino abrigam composições distintas de microbiota e células imunes, influenciando diretamente a resposta imune e a saúde geral do organismo. Esta segmentação intestinal desempenha um papel crucial para a homeostase e a defesa do corpo contra patógenos, especialmente nas interações entre a microbiota e as células imunológicas.
Os pesquisadores, liderados por H. Anandakumar e sua equipe, se concentraram em mapear as diferenças segmentares no trato gastrointestinal de camundongos, tanto convencionalmente colonizados quanto livres de germes. O objetivo principal era entender como a localização anatômica e a presença de diferentes populações microbianas afetam a abundância e a função das células imunes em diferentes partes do intestino.
Essa abordagem inovadora levou à identificação de variações significativas tanto na microbiota quanto na composição celular imune ao longo do trato gastrointestinal. A pesquisa trouxe à tona a importância da colonização microbiana para a formação de um ambiente imune adequado, com implicações importantes para o entendimento das doenças inflamatórias intestinais e outras condições imunomediadas.
Principais Descobertas
1. Padrões Segmentares de Microbiota: A microbiota do intestino delgado é menos diversificada, o que pode estar relacionado à função primária dessa região na digestão e absorção rápida de nutrientes. À medida que se avança para o intestino grosso, a diversidade microbiana aumenta substancialmente, desempenhando um papel mais proeminente na fermentação de fibras e na produção de ácidos graxos de cadeia curta (SCFAs), moléculas importantes para a manutenção da integridade da barreira intestinal.
2. Distribuição Celular Imune Dependente do Microbioma: A pesquisa demonstrou que a distribuição das células imunes, como os linfócitos T, varia de acordo com a região do intestino e a presença de microbiota. Os camundongos germ-free, por exemplo, mostraram uma diminuição acentuada na diversidade e quantidade de células imunes, evidenciando o papel da microbiota na educação e manutenção do sistema imune.
3. Interdependência Microbiana-Imune: Além das variações na microbiota, a pesquisa mostrou que a colonização microbiana é essencial para o desenvolvimento adequado de certas células imunes. Em camundongos colonizados, foi observada uma maior abundância de células T reguladoras no cólon, o que sugere uma função imunossupressora que protege contra inflamações excessivas, destacando a importância da microbiota na prevenção de doenças inflamatórias
Implicações Clínicas e Futuras Pesquisas
Essa segmentação da microbiota e das células imunes não é apenas uma curiosidade biológica; ela tem implicações profundas para o tratamento de doenças. As condições inflamatórias intestinais, como a doença de Crohn e a colite ulcerativa, podem estar associadas a uma quebra nessa relação simbiótica entre microbiota e imunidade. O entendimento de como diferentes segmentos do intestino abrigam diferentes populações de microbiota e células imunes pode guiar o desenvolvimento de tratamentos mais direcionados, incluindo probióticos e terapias baseadas na modulação da microbiota.
Além disso, este estudo abre caminho para a investigação de como a microbiota influencia a resposta imune em outras condições sistêmicas, como alergias e doenças autoimunes. O papel dos ácidos graxos de cadeia curta produzidos pelas bactérias intestinais, por exemplo, já foi associado à regulação de respostas inflamatórias e metabólicas, o que reforça a importância de entender como a dieta e o ambiente afetam a composição microbiana e, por conseguinte, a saúde imune.
Conclusão
Este estudo detalha a complexidade do ambiente intestinal, mostrando como as interações entre a microbiota e o sistema imunológico são altamente localizadas e dependentes da estrutura anatômica. Com esses novos achados, os cientistas podem agora investigar como perturbações nesse equilíbrio podem estar na raiz de várias doenças, não apenas no intestino, mas em todo o corpo. A pesquisa continua a iluminar o papel fundamental da microbiota na imunidade, fornecendo pistas vitais para futuras terapias imunomoduladoras.
Fonte:
Max Delbrück Center (MDC), *Gut Microbes*, 2024
Segmental patterning of microbiota and immune cells in the murine intestinal tract
Segmental patterning of microbiota and immune cells in the murine intestinal tract