Nanopilares Revelam como a Curvatura da Membrana Regula Contatos Cruciais com o Retículo Endoplasmático
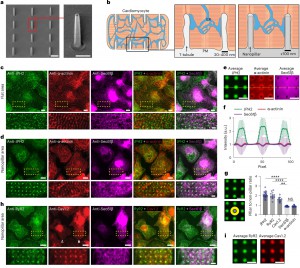
Legenda: a, Imagens de nanopilares obtidas por SEM. Barras de escala, 1 µm (esquerda) e 500 nm (direita). b, Esquerda: Esquema de um sistema de túbulos T em um cardiomiócito. Meio: Contatos ER–PM nos túbulos T. Direita: Invaginações de membrana induzidas por nanopilares. c,d, Co-imunomarcação de JPH2 (verde) e α-actinina (vermelho) em CMs-DPI expressando GFP-Sec61β (magenta) em áreas planas (c) e áreas com nanopilares (d). Parte inferior: Vistas ampliadas das regiões mostradas nas caixas amarelas. Barras de escala, 10 µm (parte superior) e 2,5 µm (parte inferior). e, Sinais fluorescentes médios de GFP-Sec61β, JPH2 e α-actinina sobre ~3.000 nanopilares; n = 18, 21 e 21 células para GFP-Sec61β, JPH2 e α-actinina, respectivamente. Barras de escala, 2,5 µm. f, Gráficos de intensidade média ao longo da linha amarela horizontal mostrada em e, normalizada pela intensidade da região entre dois nanopilares. As barras de erro representam desvio padrão entre valores de células individuais. g, Razão da intensidade de fluorescência nos nanopilares (máscara magenta) em relação à intensidade nas áreas sem pilares (máscara amarela). Barra de escala, 2,5 µm; n = 21, 10, 11, 18 e 21 células para JPH2, RyR2, Cav1.2, Sec61β e α-actinina, respectivamente. Os dados são apresentados como médias ± desvio padrão. ****P < 0,0001; **P = 0,0067. NS, não significativo (P > 0,9999). h, Co-imunomarcação de RyR2 (verde) e Cav1.2 (vermelho) em CMs-DPI expressando GFP-Sec61β (magenta) sobre nanopilares. Uma seta preenchida aponta para células com um sinal claro de Cav1.2, enquanto uma seta aberta aponta para células com sinal mínimo de Cav1.2. Barras de escala, 10 µm (parte superior) e 2,5 µm (parte inferior). i, Sinais fluorescentes médios de RyR2 e Cav1.2 sobre ~1.200 nanopilares; n = 10 e 11 células para RyR2 e Cav1.2, respectivamente. Barras de escala, 2,5 µm.
Creditos da imagem: Yang et al, 2024
Este estudo explora em detalhes como a curvatura da membrana plasmática (PM) influencia a formação de contatos entre a membrana plasmática e o retículo endoplasmático (ER), com foco em cardiomiócitos derivados de células-tronco pluripotentes induzidas (iPSC-CMs). Esses contatos ER–PM são fundamentais para a regulação do cálcio intracelular e o equilíbrio lipídico, funções críticas na fisiologia cardíaca e em outras células excitáveis.
Para estudar esses contatos, os pesquisadores utilizaram superfícies com nanopilares que induzem uma curvatura precisa da membrana. Isso permitiu observar como mudanças na topologia da membrana alteram os contatos entre o ER e a PM. Eles demonstraram que a junctofilina-2 (JPH2), uma proteína conhecida por ancorar o ER à membrana plasmática, tem um papel essencial nesses contatos. A curvatura da membrana provocada pelos nanopilares aumentou significativamente a formação dos contatos ER–PM mediada por JPH2, sugerindo que a arquitetura celular tem um impacto direto na interação entre essas organelas.
O estudo também identificou outras proteínas, como o receptor de rianodina (RyR2) e a Cav1.2, que são sensíveis à curvatura da membrana e participam da organização e funcionalidade desses contatos. Através de co-imunomarcações e técnicas avançadas de microscopia de fluorescência, os autores observaram que essas proteínas respondem de maneira distinta às áreas curvas da membrana, com níveis variados de intensidade fluorescente.
Outro aspecto chave da pesquisa foi o uso de medidas quantitativas de intensidade de fluorescência para comparar as áreas planas e curvadas, revelando que a curvatura não apenas promove a formação de contatos, mas também altera a distribuição e atividade de proteínas envolvidas na sinalização de cálcio. A combinação de análises quantitativas, modelos de nanopilares e imunomarcação detalhada revelou um panorama completo da regulação espacial desses contatos intracelulares.
A pesquisa conclui que a curvatura da membrana é um fator estrutural crucial para a organização celular, especialmente em células como cardiomiócitos, onde a sinalização precisa de cálcio é vital para a função cardíaca. Este novo entendimento abre portas para investigações futuras sobre como a topologia celular pode ser manipulada em tratamentos de doenças cardíacas e outras condições relacionadas a desregulações na comunicação interorganelar.
Plasma membrane curvature regulates the formation of contacts with the endoplasmic reticulum
Plasma membrane curvature regulates the formation of contacts with the endoplasmic reticulum