Desenvolvimento de um Novo Inibidor de Agregação de Tau Baseado em Peptídeos como Potencial Terapia para Doença de Alzheimer e Outras Tauopatias
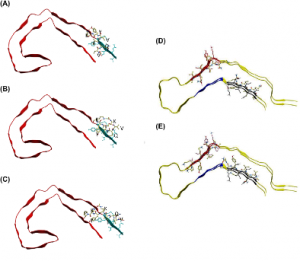
Legenda: Peptídeos VQIK(Ac)YKP se acoplam a VQIVYK. Peptídeos experimentais acoplados em paralelo à porção superior do PDB 5o3l 2N4R PHF (A–C) demonstram ligação preferencial ao 306 VQIVYK 311, enquanto os peptídeos experimentais acoplados ao filamento “snake” da Tau 2N4R no PDB 6QJH (D–E) se ligam tanto ao 306 VQIVYK 311 quanto ao 275 VQIINK 280. (A) Ac-VQIVYK-NH2; (B) AC-VQIK(Ac)YK-NH2; (C) Ac-VQIK(Ac)YKP-NH2, observe o peptídeo se estendendo para interagir com a folha β paralela do 306 VQIVYK 311. (D) Ac-VQIVYK-NH2 se ligando em paralelo ao filamento; (E) Ac-VQIK(Ac)YKP-NH2 se ligando em anti-paralelo ao filamento na posição 306 VQIVYK 311, e em paralelo na posição 275 VQIINK 280.
Creditos da imagem: Agidas et al, 2024
Este estudo investiga o desenvolvimento de um inibidor de agregação de Tau baseado em peptídeos, denominado RI-AG03, como uma terapia potencial para doenças neurodegenerativas, como a doença de Alzheimer e outras tauopatias. A Tau, uma proteína associada ao microtúbulo, desempenha um papel central em várias doenças neurodegenerativas, conhecidas como tauopatias. Na doença de Alzheimer, a Tau mal dobrada se acumula em células nervosas, formando oligômeros e emaranhados neurofibrilares tóxicos que levam à degeneração neuronal. O desenvolvimento de inibidores que possam prevenir ou reverter essa agregação tem sido foco de pesquisa como uma possível abordagem modificadora da doença.
O RI-AG03 foi projetado como um peptídeo retro-inverso baseado no hotspot de agregação 306VQIVYK311, presente em todas as isoformas da Tau, garantindo sua eficácia em diversas formas da proteína. A estabilidade do peptídeo, sua capacidade de atravessar a barreira hematoencefálica e sua habilidade de impedir a agregação de diferentes espécies de Tau foram testadas em experimentos in vitro e in vivo. Em testes laboratoriais, o RI-AG03 inibiu com sucesso a formação de agregados de Tau em células e modelos experimentais, promovendo a formação de agregados amorfos não tóxicos em vez dos agregados fibrilares tóxicos típicos da patologia da Tau.
Os experimentos in vivo utilizando o modelo de mosca-das-frutas (Drosophila melanogaster) expressando Tau humana patogênica demonstraram que o tratamento com RI-AG03 reduziu significativamente os sintomas de neurodegeneração, incluindo a melhora do fenótipo de “olho áspero”, que é característico da degeneração induzida pela Tau. Além disso, o peptídeo foi eficaz na penetração celular sem causar toxicidade significativa, uma propriedade essencial para qualquer potencial terapêutica.
O estudo concluiu que o RI-AG03 atendeu a diversos requisitos clínicos, demonstrando ser eficaz na supressão da agregação de múltiplas isoformas de Tau, não tóxico e capaz de atravessar a barreira hematoencefálica. Além disso, sua ação sobre os dois principais hotspots de agregação da Tau, 306VQIVYK311 e 275VQIINK280, o torna uma terapia promissora para uma ampla gama de tauopatias. Os autores recomendam a continuação da pesquisa com o RI-AG03 em modelos de mamíferos para confirmar seus efeitos terapêuticos. Em última análise, essa abordagem pode abrir caminho para o desenvolvimento de novas terapias modificadoras da doença para Alzheimer e outras tauopatias, retardando ou até interrompendo a progressão dessas condições neurodegenerativas devastadoras.