Traumatismo Cranioencefalico e Doença de Alzheimer
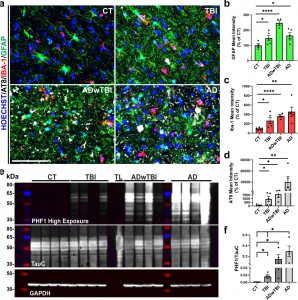
Legenda: TCE e DA aumentam a hiperfosforilação de tau e a gliose no lobo parietal inferior (IPL) de cérebros humanos. a) Imagens representativas de imunofluorescência (IF) de GFAP (verde), IBA-1 (vermelho) e AT8 (branco) no IPL de tecido cerebral humano pós-morte (CT, TCE, DA com histórico de TCE (ADwTBI) e DA sem histórico de TCE (AD)). Barra de escala, 100 μm. b, c) Quantificação da intensidade média de (b) GFAP e (c) IBA-1 no IPL (*P < 0,05, **P < 0,01, ****P < 0,0001 vs CT; teste t não pareado, n = 4–5 casos/grupo). d) Quantificação da intensidade média de AT8 no IPL (*P < 0,05, **P < 0,01 vs CT; teste t não pareado, n = 4–5 casos/grupo). Os núcleos de todas as imagens foram corados com Hoechst 33342. e) Os lisados totais de proteínas do IPL de casos de CT, TCE, ADwTBI e DA foram submetidos ao ensaio de Western blot (WB) com anticorpos específicos contra PHF1 de camundongo (topo), TauC de coelho (meio) e GAPDH de coelho (fundo, controle de carregamento). TL: escada de tau recombinante com 6 isoformas da proteína tau. As isoformas estão na ordem: 2N4R, 2N3R, 1N4R, 1N3R, 0N4R, 0N3R. f) Quantificação da razão de PHF1/TauC (*P < 0,05 TCE vs CT, ADwTBI vs CT, DA vs CT, e DA vs TCE; teste de Mann–Whitney, n = 4 casos/grupo).
Creditos da imagem: Sweeney et al, 2024
Pesquisadores descobriram que a proteína BAG3 tem um papel essencial na atenuação de disfunções cerebrais relacionadas à fosforilação anormal da proteína tau, que frequentemente ocorre após uma lesão cerebral traumática (TBI). Este estudo foi motivado pela crescente evidência de que pessoas que sofrem TBI têm um risco maior de desenvolver doenças neurodegenerativas, como a Doença de Alzheimer (AD).
Após um TBI, observou-se uma redução na expressão da BAG3 em neurônios e oligodendrócitos, células importantes para o funcionamento cerebral. Esta queda na BAG3 está associada a um aumento da proteína tau hiperfosforilada (ptau), um marcador chave da neurodegeneração. Além disso, o acúmulo de ptau foi relacionado à disfunção sináptica, glioses (reações inflamatórias do sistema nervoso) e comprometimento cognitivo em modelos experimentais, tanto em ratos selvagens quanto em ratos modificados geneticamente para expressar tau humano (hTKI). Esses resultados também foram confirmados em cérebros humanos pós-morte de pessoas com histórico de TBI e casos de Alzheimer.
Curiosamente, a superexpressão de BAG3 em neurônios do hipocampo conseguiu reverter parte dos efeitos nocivos do TBI. Os animais que receberam BAG3 apresentaram menos acúmulo de tau hiperfosforilada, melhoras nas sinapses e redução nos déficits cognitivos, sugerindo que a BAG3 promove a regulação do sistema de autofagia-lisossomo, um mecanismo essencial para a eliminação de proteínas danificadas nas células.
Estes resultados apontam a BAG3 como um alvo promissor para o desenvolvimento de terapias que visem reduzir os efeitos de TBI e prevenir o desenvolvimento de patologias semelhantes à AD. Aumentar a expressão de BAG3 pode melhorar a capacidade do cérebro de combater o acúmulo de tau, melhorar a função sináptica e preservar a cognição.
O estudo destaca o papel protetor da BAG3 e abre caminho para novas estratégias terapêuticas no combate às doenças neurodegenerativas induzidas por TBI. Ao modular os níveis dessa proteína, seria possível atenuar a progressão de patologias cerebrais relacionadas ao tau e melhorar a qualidade de vida de pacientes que sofreram lesões cerebrais traumáticas.