Avanços na Edição Gênica do Locus NCF1: Promessas e Desafios doe Uso de CRISPR para o Tratamento de Doencas Geneticas
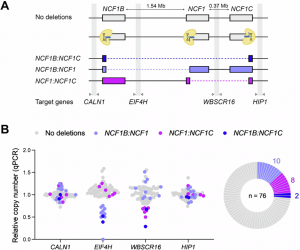
Legenda: A: Um esquema mostra as posições relativas do gene NCF1 e seus pseudogenes, destacando as regiões potencialmente afetadas por deleções cromossômicas (indicadas por linhas pontilhadas) resultantes do tratamento com CRISPR-Cas. As regiões incluem CALN1, a montante de NCF1B, EIF4H entre NCF1B e NCF1, WBSCR16 entre NCF1 e NCF1C, e HIP1 a jusante de NCF1C, juntamente com os genes alvo para qPCR (indicados por setas). B: Números relativos de cópias foram detectados por qPCR em linhagens monoclonais. Os pontos com cores indicam os tipos de deleções identificados em clones únicos: cinza para clones sem deleções, azul claro para deleções entre NCF1B ,roxo para deleções entre NCF1 e azul para deleções entre NCF1B. O gráfico em formato de donut mostra a proporção de clones com deleções ocorrendo entre os loci de NCF1.
Creditos da imagem: Raimondi et al, 2024
No campo da medicina genética, cientistas estão explorando novas possibilidades de correção de doenças relacionadas a pseudogenes, como a doença granulomatosa crônica (DGC), que afeta a imunidade inata dos fagócitos. Essa condição genética, causada principalmente por mutações no gene NCF1, leva à deficiência funcional da proteína p47phox, essencial para a produção de espécies reativas de oxigênio, fundamentais no combate a infecções.
Recentemente, estudos com tecnologia CRISPR-Cas9 focaram na edição genética de NCF1 e de seus pseudogenes associados, NCF1B e NCF1C, em células humanas e células-tronco hematopoiéticas de pacientes. O objetivo é corrigir mutações específicas e restaurar a capacidade imunológica desses pacientes. No entanto, embora promissores, os resultados revelam um desafio importante: a alta similaridade entre o gene NCF1 e seus pseudogenes gera uma predisposição para rearranjos cromossômicos indesejados, levando a deleções e duplicações no genoma que podem comprometer a segurança da terapia.
A equipe de pesquisadores aplicou diferentes abordagens de edição genética para minimizar esses efeitos colaterais, como o uso de ribonucleoproteínas de Cas9 e o emprego de templates de correção específicos. Além disso, exploraram alternativas como o uso de Cas9 inativo para evitar múltiplas quebras simultâneas nas regiões de NCF1, que, ao competir pelos mesmos alvos, reduziria a incidência de eventos de recombinação. Mesmo com essas estratégias, as taxas de rearranjos cromossômicos se mostraram desafiadoras, o que sugere que uma combinação de técnicas ou a implementação de métodos de edição mais precisos, como a edição por prime editing, pode ser necessária para o uso clínico seguro.
Este estudo traz insights valiosos para o desenvolvimento de terapias gênicas personalizadas. Ele destaca a necessidade de uma avaliação cuidadosa do contexto genômico específico antes de qualquer intervenção genética, considerando os riscos de instabilidade genômica que ainda desafiam a prática clínica. À medida que a tecnologia avança, espera-se que futuras abordagens permitam uma correção mais eficiente e segura do gene NCF1 e de outras regiões de alta homologia, pavimentando o caminho para tratamentos inovadores para pacientes com DGC e outras doenças genéticas raras.
Gene editing of NCF1 loci is associated with homologous recombination and chromosomal rearrangements
Gene editing of NCF1 loci is associated with homologous recombination and chromosomal rearrangements