Memória Epigenética da Obesidade: O Desafio de Vencer o Efeito “Iô-Iô”
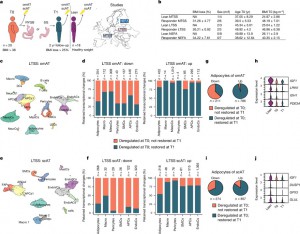
Legenda: a, biópsias de omAT e scAT foram coletadas de pessoas vivendo com obesidade durante a BaS (T0) e 2 anos após a cirurgia (T1). Apenas indivíduos que perderam pelo menos 25% do IMC em comparação com T0 foram incluídos. Biópsias de omAT e scAT foram coletadas de indivíduos com peso saudável/magro dos mesmos estudos (MTSS, LTSS e NEFA).b, Sexo, idade, IMC inicial e perda de IMC de doadores magros e doadores com obesidade.c, Aproximação e projeção uniforme do manifold (UMAP) de 22.742 núcleos representando pools de omAT de indivíduos magros (n = 5; 2 homens, 3 mulheres) e omAT pareados de T0 e T1 (n = 5 cada; 2 homens, 3 mulheres) do LTSS.
d, Proporção de mudanças transcricionais mantidas em tipos celulares altamente abundantes de omAT do LTSS. e, UMAP de 15.347 núcleos representando pools de scAT de indivíduos magros (n = 5; 2 homens, 3 mulheres) e scAT pareados de T0 e T1 (n = 5 cada; 2 homens, 3 mulheres) do LTSS. f, Proporção de mudanças transcricionais mantidas em tipos celulares altamente abundantes de scAT do LTSS. g, Proporção de mudanças transcricionais mantidas em adipócitos integrados de omAT do LTSS e omAT do MTSS. h, Expressão normalizada de DEGs selecionados relacionados à memória em adipócitos de omAT. i, Proporção de mudanças transcricionais mantidas em adipócitos integrados de omAT do LTSS e scAT do NEFA. j, Expressão normalizada de DEGs selecionados relacionados à memória em adipócitos de scAT. O teste de soma de postos de Wilcoxon com P ajustado < 0,01 pelo método de correção de Bonferroni e mudança de dobra log2 (log2FC) > ±0,5 foi usado para identificação de DEG em d, f, g, h, i e j. DCs, células dendríticas; EndoCs, células endoteliais; EndoACs, EndoCs arteriolares; EndoSCs, EndoCs do caule; EndoVCs, EndoCs venulares; LECs, EndoCs linfáticas; FAPs, progenitores fibro-adipogênicos; Macro, macrófagos; MastCs, mastócitos; MesoCs, células mesoteliais; NeurCs, células semelhantes a neurônios; SMCs, células musculares lisas (vasculares); NA, não aplicável; m/f, masculino/feminino. Crédito: a, Copyright 2017—Simplemaps.com (https://simplemaps.com/resources/svg-maps).
Creditos da imagem: Hinte et al, 2024
Pesquisas recentes revelaram que o tecido adiposo, tanto em humanos quanto em camundongos, mantém uma “memória epigenética” das alterações metabólicas causadas pela obesidade, mesmo após uma perda significativa de peso. Essa memória, ancorada em mudanças estáveis na regulação gênica, desempenha um papel fundamental no efeito “io-iô”, um fenômeno comum em que o peso perdido é rapidamente recuperado.
Utilizando sequenciamento de RNA de núcleo único (snRNA-seq) e análises epigenéticas em humanos e camundongos, os pesquisadores identificaram alterações persistentes na expressão gênica de adipócitos e outros tipos celulares no tecido adiposo, mesmo após intervenções como cirurgia bariátrica ou mudança para uma dieta de baixa caloria. Essas alterações não apenas permaneceram após a perda de peso, mas também se mostraram associadas a respostas prejudicadas a novos estímulos metabólicos.
Em camundongos, a memória epigenética foi associada a modificações em adipócitos, incluindo padrões alterados de metilação de DNA e mudanças em marcas de histonas que regulam a acessibilidade cromatínica. Essas alterações resultaram em uma predisposição para ganho de peso acelerado quando expostos novamente a dietas ricas em gorduras. Além disso, os adipócitos de camundongos que perderam peso apresentaram maior inflamação e menor capacidade metabólica, destacando as consequências duradouras da obesidade inicial.
Estudos em biópsias de tecido adiposo de pacientes submetidos à cirurgia bariátrica mostraram que, mesmo após uma redução significativa no índice de massa corporal (IMC), muitas alterações genéticas associadas à obesidade não retornaram ao estado “normal”. Esses resultados sugerem que a obesidade induz uma assinatura epigenética duradoura, que pode explicar a dificuldade em manter o peso após a perda.
A pesquisa também demonstrou que adipócitos com memória epigenética exibem alterações funcionais, como uma maior propensão a acumular lipídios e a reativar vias inflamatórias, o que contribui para o desenvolvimento de complicações metabólicas. Em humanos, essas alterações estão ligadas à persistência de comorbidades relacionadas à obesidade, como resistência à insulina e inflamação crônica, mesmo após intervenções bem-sucedidas de perda de peso.
As descobertas têm implicações significativas para o manejo da obesidade e de suas complicações metabólicas. Embora a perda de peso seja essencial para melhorar a saúde metabólica, ela sozinha pode não ser suficiente para apagar a memória epigenética da obesidade. Isso sugere a necessidade de estratégias terapêuticas que abordem diretamente essas alterações epigenéticas para melhorar os resultados de longo prazo.
Agonistas de receptores de incretinas, como semaglutida e tirzepatida, emergem como tratamentos promissores para induzir perda de peso sem cirurgia, mas os estudos indicam que, uma vez interrompidos, a recuperação do peso é comum. Assim, a pesquisa destaca a necessidade de investigar se esses medicamentos podem modificar ou apagar a memória epigenética de forma mais eficaz do que outras intervenções.
O estudo levanta questões cruciais: como a memória epigenética da obesidade pode ser “reprogramada”? Até que ponto outros tratamentos, como modificações globais no epigenoma ou edição epigenética direcionada, podem ser aplicados para apagar essas marcas duradouras? Será que estratégias não invasivas, como mudanças no microbioma intestinal, podem influenciar a retenção dessa memória?
A memória epigenética da obesidade representa um desafio significativo para o tratamento de longo prazo, mas também uma oportunidade. Ao desvendar os mecanismos moleculares subjacentes, esta pesquisa oferece um novo caminho para desenvolver terapias personalizadas que ajudem a superar o efeito “io-iô” e a melhorar os resultados metabólicos e de saúde para milhões de pessoas ao redor do mundo.
Adipose tissue retains an epigenetic memory of obesity after weight loss
Adipose tissue retains an epigenetic memory of obesity after weight loss