A Resistência do Hepatovírus: Revelando o Papel Crucial da PDAP1 na Tradução e Sobrevivência Celular Sob Estresse
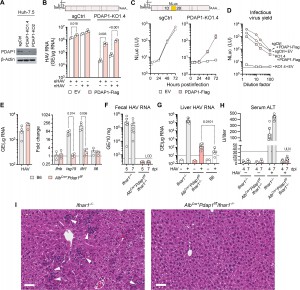
Legenda: (A) Imunoblots mostrando a expressão de PDAP1 em células deficientes em PDAP1 (PDAP1-KO1.4 e PDAP1-KO-2) em comparação com células controle (sgCtrl) transduzidas com sgRNA não direcionado. (B) RNA de HAV quantificado por RT-PCR em células PDAP1-KO1.4 e controle sgCtrl 72 horas após a inoculação do vírus 18f, quasi-envelopado (eHAV) ou não envelopado (nHAV), purificado em gradiente. As células foram transduzidas com lentivírus expressando PDAP1-Flag ou vetor vazio (EV) antes do desafio com HAV. (C) NLuc expresso pelo vírus repórter 18f-NLuc em células PDAP1-KO1.4 versus sgCtrl, com ou sem reconstituição de PDAP1 como em (B). LU, unidades de luz. (D) Vírus infeccioso liberado de células PDAP1-KO1.4 e sgCtrl 24 horas após a infecção [com e sem reconstituição de PDAP1 como em (C)] foi quantificado pela inoculação de diluições do fluido do sobrenadante de cultura celular em células Huh-7.5 naïve, com a atividade de NLuc medida 72 horas depois. Os dados apresentados em (B) a (D) são médias ± DP de N = 3 réplicas técnicas de experimentos representativos. (E) (Esquerda) Abundância de RNA de HAV e (direita) variação no nível de transcritos de genes de resposta imune inata 15 horas após desafio intravenoso com vírus em camundongos machos AlbCre+Pdap1f/f ou B6. N = 4, valores de P pelo teste t bicaudal. GE, equivalentes genômicos. (F) Abundância de RNA de HAV em fezes de camundongos machos Ifnar1−/− versus AlbCre+Pdap1f/fIfnar1−/− (N = 5 a 6) determinada por RT-qPCR 5 e 7 dias após a inoculação do vírus (dpi). LOD, limite de detecção. (G) Abundância de RNA viral nos fígados de camundongos machos Ifnar1−/−, AlbCre+Pdap1f/fIfnar1−/− ou B6 (N = 5 a 8) inoculados com 2 × 10⁶ GE de vírus 7 dpi. Valor de P pelo teste de Mann-Whitney bicaudal. (H) Atividades séricas de ALT em camundongos Ifnar1−/− ou AlbCre+Pdap1f/fIfnar1−/− 4 e 7 dpi. ULN, limite superior da normalidade. Cada símbolo em (E) e (F) representa um animal individual; as colunas representam médias ± DP. (I) Seções representativas coradas com H&E de fígados de camundongos Ifnar1−/− ou AlbCre+Pdap1f/fIfnar1−/− 7 dias após desafio intravenoso com vírus. As setas indicam hepatócitos apoptóticos com células inflamatórias ao redor. Barras de escala, 50 μm.
Creditos da imagem: Shirasaki et al, 2024
O artigo publicado por Shirasaki et al. na Science Advances (vol. 10, eadq6342, 2024) explora os mecanismos de tradução do RNA do hepatovírus (HAV), o agente causador da hepatite A, destacando o papel essencial da proteína PDAP1. Este estudo revela que o HAV adota uma estratégia de tradução independente de cap que é resistente ao estresse celular, garantindo a síntese de proteínas virais mesmo em condições desfavoráveis. O mecanismo envolve a entrada interna de ribossomo (IRES), que depende da interação com fatores de tradução como eIF4E e PDAP1. Esta última, uma fosfoproteína de função até então pouco compreendida, interage diretamente com eIF4E e eIF1A, estabilizando os complexos de pré-iniciação e promovendo a tradução do RNA do HAV. A pesquisa mostrou que, na ausência de PDAP1, a tradução mediada por IRES é severamente prejudicada, resultando em uma redução significativa na replicação viral em células e em modelos murinos. Além disso, o estudo demonstra que a PDAP1 é indispensável para a tradução de RNAs celulares que codificam proteínas essenciais para a sobrevivência celular em condições de estresse, como as proteínas BiP e XIAP. Em hepatócitos deficientes em PDAP1, a resposta adaptativa ao estresse do retículo endoplasmático (ER) é comprometida, levando a danos celulares mais acentuados e à falha na produção de proteínas críticas para a homeostase celular. O estudo também destaca a relação da PDAP1 com respostas ao estresse em tecidos normais e suas possíveis implicações em processos associados ao câncer, sugerindo que esta proteína desempenha um papel mais amplo na regulação da tradução celular e na adaptação ao estresse. Utilizando uma combinação de métodos como knockouts genéticos via CRISPR-Cas9, estudos proteômicos e análises de perfis de polissomas, os autores elucidaram o papel molecular da PDAP1, reforçando sua importância na replicação viral e na sobrevivência de células sob estresse. Este trabalho não apenas avança nossa compreensão sobre as interações entre vírus e hospedeiro, mas também aponta a PDAP1 como um potencial alvo terapêutico para controlar infecções virais e outras condições associadas ao estresse celular, como doenças inflamatórias e câncer