Estimulação Vagal e a Modulação da Colite: O Papel Regulador da SUMOilação nas Respostas Imunes
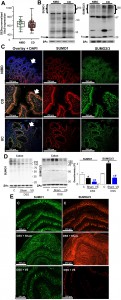
Legenda: (A) Contagens normalizadas pelo DEseq para a expressão de Ubc9 em amostras de biópsia de 29 pacientes sem doenças inflamatórias intestinais (NIBD) e 91 pacientes com doença de Crohn (CD) (P = 0,34). Dados de sequenciamento de célula única estão disponíveis sob o acesso GEO GSE164985. (B) Blots de Western e (C) imunohistoquímica (IHC) representativa para SUMO1 (vermelho, coluna central) e SUMO2/3 (verde, coluna da direita) de biópsias de cólon de NIBD (linha superior) e pacientes com colite ulcerativa (UC, linha do meio) e CD (linha inferior). Imagens mescladas são mostradas na coluna da esquerda (os núcleos foram corados em azul com DAPI). Os dados mostram resultados representativos de sete biópsias de 18 amostras humanas analisadas. Os colchetes em (B) indicam os típicos “smears” de alto peso molecular induzidos pela SUMOilação.
Creditos da imagem: Youssef et al, 2024
O artigo publicado por Ayman Youssef e colaboradores na Science Translational Medicine (vol. 16, eadl2184, 2024) explora como a estimulação do nervo vago pode modular a resposta inflamatória em modelos murinos de colite, destacando o papel crítico da SUMOilação, uma modificação pós-traducional que regula interações e funções proteicas em situações de estresse. Os pesquisadores demonstraram que a redução do tônus parassimpático autonomo aumenta a suscetibilidade e a mortalidade em modelos experimentais de doenças inflamatórias intestinais (IBDs), enquanto a estimulação vagal reestabelece a neuromodulação e melhora a colite, inibindo a SUMOilação.
Os dados indicaram que a SUMOilação, especialmente mediada pelas isoformas SUMO2 e SUMO3, está aumentada durante fases ativas da doença tanto em biópsias de pacientes quanto em modelos murinos. A deleção genética de Sumo3 retardou o início da colite, enquanto a deleção de Sumo1 inibiu sua progressão. Além disso, transplantes de medula óssea de camundongos Sumo1-KO para camundongos selvagens conferiram proteção contra o desenvolvimento de colite, enquanto a estimulação elétrica do nervo vago reduziu significativamente os marcadores inflamatórios e a permeabilidade intestinal. Essas descobertas sugerem que a estimulação vagal regula a colite através de mecanismos dependentes e independentes de citocinas, como a IL-10, e a modulação da SUMOilação.
Adicionalmente, o estudo revelou que o inibidor de SUMOilação TAK-981 mimetizou os efeitos da estimulação vagal, protegendo contra a colite em múltiplos modelos murinos, reduzindo a inflamação, preservando a integridade intestinal e minimizando a translocação bacteriana e a progressão para sepse. Estes resultados sugerem que a SUMOilação é um alvo terapêutico promissor para doenças inflamatórias intestinais, oferecendo potencial para intervenções tanto bioeletrônicas quanto farmacológicas.
Concluindo, o trabalho avança o entendimento sobre os mecanismos de regulação imune mediados pelo nervo vago e posiciona a SUMOilação como um eixo central na modulação das respostas adaptativas ao estresse, com implicações significativas para o manejo clínico de IBDs.
Vagal stimulation ameliorates murine colitis by regulating SUMOylation
Vagal stimulation ameliorates murine colitis by regulating SUMOylation