Separação de fases: O Papel dos Hubs de Iniciação na Autofagia Seletiva
Legenda: Interações de alta afinidade entre receptor e carga prejudicam a autofagia seletiva.
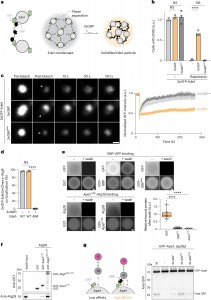
a, Esquema da solidificação de condensados END. Setas cinzas tracejadas indicam interações de baixa afinidade.
b, Células expressando 2×GFP–Ede1 sem (cinza claro), com BFP–3×GBP (laranja) ou com BFP–3×GBPlow (cinza escuro), sob o controle de um promotor indutível por cobre, foram cultivadas até a fase de crescimento exponencial médio na presença de 1 mM de CuSO4 por 6 horas. A autofagia foi então induzida pela adição de rapamicina. Quantificação:células com condensados END. Os dados representam valores médios (n > 150 células por condição e repetição, três replicações biológicas). Círculos indicam os valores médios de cada repetição; barras mostram a média. A análise estatística foi realizada por um teste t não pareado bicaudal. Valores de P: sem tratamento: −3×GBP (–) versus +3×GBP, P = 0,0978; −3×GBP (–) versus +3×GBPlow, P = 0,5104; rapamicina: −3×GBP (–) versus +3×GBP, ****P < 0,0001; −3×GBP (--) versus +3×GBPlow, P = 0,1363.
c, As linhagens −3×GBP (–), +3×GBP e +3×GBPlow foram cultivadas até a fase de crescimento exponencial médio, conforme descrito em b. Assembléias de 2×GFP–Ede1 foram fotobranqueadas, e a recuperação do sinal foi monitorada. As setas brancas indicam a área fotobranqueada. Escala: 1 μm. Quantificação: recuperação do sinal GFP. Dados são apresentados como médias ± erro padrão da média (n > 26 ENDs por condição em todas as replicações, três replicações biológicas).
d, Uma linhagem de 2×GFP–Ede1 sem (−) e com (+) 3×GBP e uma linhagem mutante 2×GFP–Ede1AIM (mutante de ligação Atg8) com +3×GBP coexpressando mCherry–Atg8 foram cultivadas até a fase de crescimento exponencial médio na presença de 1 mM de CuSO4. Estruturas positivas para GFP/mCherry foram quantificadas. Dados representam valores médios (n > 100 ENDs por condição e repetição, três replicações biológicas). Círculos indicam os valores médios de cada repetição; barras mostram a média. A análise estatística foi realizada por um teste t não pareado bicaudal. Valores de P: WT(−) versus WT(+), P = 0,525; WT(+) versus AIM(+), ****P < 0,0001. AIM, mutante de ligação Atg8.
e, GST–BFP, GST–BFP–GBP, GST–BFP–GBPlow e GST–BFP–Ape11–45 foram expressos em Escherichia coli e ligados a esferas de GSH. Esferas ligadas às proteínas foram incubadas com lisados de células de E. coli contendo 6×His–GFP ou mCherry–Atg19, e as proteínas GFP ou mCherry–Atg19 ligadas foram analisadas antes e após a lavagem. Escala: 20 μm. Quantificação: razão entre proteína ligada à esfera e proteína solúvel, em um gráfico de caixa. Linhas horizontais mostram a mediana; caixas representam os percentis 25 a 75; linhas indicam os percentis 5 a 95; círculos mostram os valores médios de cada repetição; pontos pretos indicam valores discrepantes (n > 25 esferas por condição em todas as replicações, três replicações técnicas). A análise estatística foi realizada por ANOVA de uma via seguida pelo teste post hoc de Dunnett. Valores de P: GBP versus GBPlow, ****P < 0,0001; GBP versus Ape11–45, ****P < 0,0001.
f, GST, GST–Ape11–45 e GST–Atg11685–1178 foram expressos em E. coli e ligados a esferas de GSH. Estas foram incubadas com Atg193D recombinante purificado e analisadas por imunotransferência. Um experimento de três replicações técnicas é mostrado.
g, Células atg19∆ expressando GFP–Ape1 e Atg19, um vetor controle vazio (−), Atg19–GBP, Atg19–GBPlow ou Atg19–GBPmed foram cultivadas até a fase de crescimento exponencial médio. Extratos celulares foram analisados por imunotransferência. Um experimento de três replicações biológicas é mostrado.
Creditos da imagem: Licheva et al, 2025
O artigo explora o papel essencial da separação de fases líquidas na formação e regulação de hubs de iniciação durante a autofagia seletiva, um processo celular crítico para a manutenção da homeostase ao eliminar seletivamente organelas danificadas, agregados proteicos e outras cargas celulares. Usando modelos de leveduras e células humanas, os pesquisadores elucidam como interações moleculares específicas promovem a organização espacial e funcional das proteínas autofágicas no ambiente celular.
Principais Descobertas:
Formação de hubs de iniciação na superfície das cargas celulares:
Proteínas fundamentais da biogênese autofágica, como Atg11, Atg19 e Atg9, formam condensados dinâmicos na superfície das cargas celulares por meio de separação de fases líquidas. Esses hubs de iniciação servem como plataformas para recrutar outros componentes do maquinário autofágico, facilitando a formação do fagóforo e o início da autofagia.
Importância das interações multivalentes e de baixa afinidade:
Interações receptor-carga de baixa afinidade, mas multivalentes, são cruciais para a formação dos hubs de iniciação. Essas interações permitem alta mobilidade dos receptores na superfície da carga, promovendo a organização de clusters de proteínas necessários para a montagem do fagóforo. Em contraste, interações de alta afinidade estabilizam excessivamente os receptores e impedem a formação dos hubs, bloqueando o progresso da autofagia.
Separação de fases e controle espacial da autofagia:
O estudo demonstra que os hubs de iniciação não se distribuem uniformemente na superfície das cargas, mas se organizam em focos que facilitam a ligação a componentes do retículo endoplasmático (RE). Essa conexão é essencial para a formação do local de montagem do fagóforo (PAS, do inglês Phagophore Assembly Site), onde ocorre a biogênese da membrana autofágica.
Conservação evolutiva do mecanismo:
Experimentos em células humanas mostraram que hubs de iniciação também se formam em cargas celulares específicas e que proteínas como ULK1 (equivalente de Atg1 em humanos) desempenham papéis semelhantes aos observados em leveduras. A interação entre os hubs e o RE em células humanas é mediada por FIP200 e Vac8, destacando a conservação evolutiva do mecanismo.
Engenharia de neo-cargas para autofagia seletiva:
A pesquisa apresentou uma abordagem inovadora ao transformar a proteína viral µNS, que normalmente não é degradada por autofagia, em um neo-alvo autofágico. Isso foi alcançado ao criar interações de baixa afinidade entre a proteína e receptores de autofagia, desencadeando a formação de hubs de iniciação e sua posterior degradação.
Relevância e Implicações:
Este trabalho fornece insights fundamentais sobre como a separação de fases líquidas regula a autofagia seletiva, destacando a importância de interações moleculares de baixa afinidade e organização espacial na montagem do maquinário autofágico. As descobertas têm implicações amplas, desde a compreensão de doenças relacionadas ao acúmulo de proteínas, como neurodegeneração, até a exploração de estratégias para manipular a autofagia em aplicações biotecnológicas e terapêuticas.
Ao integrar análises moleculares e celulares avançadas, o estudo estabelece uma base sólida para futuras investigações sobre a regulação da autofagia e sua aplicabilidade na medicina de precisão.
Phase separation of initiation hubs on cargo is a trigger switch for selective autophagy
Phase separation of initiation hubs on cargo is a trigger switch for selective autophagy