Conexão Intestino-Microbiota: Como o Metabolismo do Hospedeiro Regula a Sinalização Mediada por Ácidos Biliares
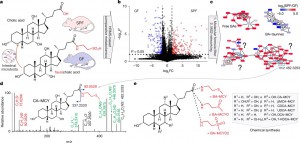
Legenda: a. Papel principal da microbiota intestinal no metabolismo dos ácidos biliares (ABs) e visão geral esquemática da estratégia analítica para comparação entre camundongos germ-free (GF) e específicos para patógenos (SPF).
b. Gráficos de vulcão mostrando os metabólitos diferenciais detectados no soro de camundongos germ-free (n = 12) e SPF (n = 9). Os pontos azuis e vermelhos representam metabólitos cuja abundância foi reduzida ou aumentada em pelo menos cinco vezes nos camundongos germ-free em comparação aos SPF, com P < 0,05, conforme calculado por um teste t bilateral para amostras independentes. FC, variação (fold change).
c. Representação parcial das redes de MS2 (coseno > 0,7) para soro de camundongo obtido em modos de ionização por eletrospray em íons positivos (ESI+) e íons negativos (ESI−). As redes mostram clusters que representam ABs livres, conjugados de AB com taurina e conjugados de AB-MCY previamente não anotados. Os nós vermelhos e azuis indicam metabólitos com redução ou aumento nos níveis, respectivamente, no soro dos camundongos germ-free em comparação aos SPF. Consulte as Figuras Suplementares 1–3 para redes completas de MS2, incluindo valores de m/z para todos os nós.
d. Espectro MS2 do conjugado CA–MCY. Os fragmentos MS2 em vermelho representam o grupo MCY, enquanto os fragmentos em verde são derivados da perda de água.
e. Estruturas dos conjugados de AB-MCY identificados no soro de camundongos.
Creditos da imagem: Won et al, 2025
Este estudo investiga como o metabolismo do hospedeiro interage com a microbiota intestinal para regular a sinalização dos ácidos biliares (ABs), moléculas essenciais para o metabolismo, a resposta imunológica e o equilíbrio energético. Utilizando metabolômica não direcionada em camundongos com diferentes condições microbiológicas (germ-free e com microbiota normal), os pesquisadores descobriram uma nova classe de conjugados de ABs com metilcisteamina (AB-MCY). Esses conjugados, cuja produção depende da enzima VNN1 expressa no intestino, funcionam como antagonistas do receptor nuclear FXR, diferentemente dos ABs livres, que são agonistas do FXR.
Os AB-MCYs modulam a expressão de genes-chave na biossíntese de ABs, como Cyp7a1 e Cyp8b1, promovendo a produção de ácidos biliares no fígado. A abundância desses conjugados depende tanto da microbiota quanto de fatores dietéticos, como a suplementação com fibras, que aumenta a disponibilidade de ABs livres e, consequentemente, a produção de AB-MCYs. A pesquisa também mostrou que a suplementação com AB-MCYs em modelos de camundongos com hipercolesterolemia reduziu significativamente a acumulação de lipídios no fígado, destacando seu potencial terapêutico em doenças metabólicas e hepáticas.
Adicionalmente, os AB-MCYs são metabolizados tanto pelo hospedeiro quanto pela microbiota. Em condições germ-free, sua presença é reduzida, mas não eliminada, sugerindo que sua produção ocorre de forma independente da microbiota. No entanto, a deconjugação de AB-MCYs em compostos livres é mediada por enzimas microbianas, como a bile salt hydrolase (BSH).
O estudo revela que os AB-MCYs equilibram a sinalização mediada pelo FXR, criando um sistema de feedback entre o hospedeiro e a microbiota. Este equilíbrio regula a produção de ácidos biliares, o metabolismo de lipídios e a reciclagem de coenzima A (CoA), conectando o estado nutricional do hospedeiro às funções metabólicas e imunológicas. A presença de AB-MCYs no soro humano sugere que esses mecanismos também são relevantes em humanos e podem ser modulados por intervenções dietéticas, apontando para novas possibilidades terapêuticas em condições de disfunção metabólica e inflamatória.
Host metabolism balances microbial regulation of bile acid signalling
Host metabolism balances microbial regulation of bile acid signalling