Controle de Entrega Intracelular de Proteínas e Colonização Tumoral por Salmonella Geneticamente Modificada: Um Novo Paradigma no Tratamento do Câncer
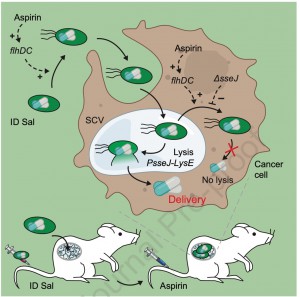
Legenda: Alvejar seletivamente vias intracelulares dentro de células cancerígenas desbloqueia um potencial terapêutico significativo. Forbes e colegas criaram um vetor de entrega baseado em bactérias, clinicamente aplicável, que coloniza tumores de forma seletiva. Uma dose de aspirina disponível sem prescrição médica ativa as bactérias intratumorais para entregar terapias contra o câncer diretamente dentro das células tumorais, reduzindo a carga da doença sem causar toxicidade sistêmica.
Creditos da imagem: Forbes et al, 2025
A entrega direcionada de terapêuticos macromoleculares ao interior de células tumorais representa um desafio significativo na oncologia. Este estudo apresenta o desenvolvimento e a caracterização de uma cepa geneticamente modificada de Salmonella enterica (denominada ID-Salmonella) com capacidade de entrega intracelular de proteínas terapêuticas. A modificação se baseou no controle da expressão do regulador mestre flhDC, que desempenha um papel central na produção de flagelos, motilidade bacteriana e invasão de células hospedeiras.
O trabalho propõe que o controle preciso de flhDC pode resolver limitações observadas em ensaios clínicos anteriores envolvendo bactérias terapêuticas, como baixa colonização tumoral e ativação precoce de respostas imunológicas sistêmicas devido à expressão de flagelos. Para isso, a expressão de flhDC foi regulada pelo promotor responsivo a salicilato (Psal), cuja indução pode ser controlada pelo metabolismo do ácido acetilsalicílico (aspirina). Adicionalmente, foram incorporadas etiquetas de degradação ssrA para modular a expressão basal de flhDC e evitar atividade indesejada antes da indução.
Aspectos Experimentais e Resultados Chave:
Regulação da Expressão de flhDC:
Foram construídas variantes de ID-Salmonella com diferentes etiquetas de degradação ssrA (baixa, média e alta força). A variante com etiqueta de força média apresentou o melhor equilíbrio entre supressão da expressão basal e capacidade de invasão após indução com salicilato.
A motilidade bacteriana foi significativamente aumentada após indução, com velocidade 12,7 vezes maior em relação às bactérias não induzidas. Essa motilidade é essencial para a dispersão intratumoral e invasão celular.
Efeito da Exclusão de sseJ:
O gene sseJ, relacionado à ruptura de vacúolos intracelulares (Salmonella-containing vacuoles, SCVs), foi excluído para melhorar a retenção vacuolar. Bactérias com sseJ deletado permaneceram mais tempo nos vacúolos, o que aumentou a eficiência da entrega intracelular de proteínas terapêuticas.
Em culturas celulares, a combinação de indução de flhDC e deleção de sseJ resultou em um aumento de 2,4 vezes na entrega proteica em comparação às bactérias controle.
Colonização Tumoral:
Otimizações no controle de flhDC demonstraram que a supressão de sua expressão antes da injeção sistêmica aumenta a colonização tumoral em até 11 milhões de vezes. Após a colonização inicial, a indução de flhDC intensifica a invasão celular e a distribuição intratumoral.
Em experimentos com modelos murinos, as bactérias colonizaram tumores e regiões metastáticas 280 a 800 vezes mais do que tecidos saudáveis adjacentes, evidenciando alta especificidade tumoral.
Entrega de Terapêuticos e Eficácia Antitumoral:
ID-Salmonella foi modificada para entregar uma versão constitutivamente ativa da caspase-3 (CT Casp-3), uma proteína pró-apoptótica. Essa entrega levou a maior indução de morte celular em culturas de câncer de mama (MCF7), pâncreas (KPCY) e fígado (HUH7), superando tratamentos controle em até 3,2 vezes.
Em modelos in vivo, a administração repetida de ID-Salmonella com CT Casp-3 resultou em redução significativa do volume tumoral em comparação com tratamentos convencionais, como paclitaxel.
Especificidade Metastática:
Em modelos de câncer de mama metastático, as bactérias colonizaram quase exclusivamente áreas metastáticas no fígado e pulmão. As colônias em tecido metastático foram em média 118 vezes maiores que em tecidos saudáveis, com 99,88% das bactérias localizadas em regiões malignas.
Essa especificidade permitiu a entrega eficiente de proteínas terapêuticas às células malignas, aumentando em três vezes a cobertura proteica em comparação a controles não induzidos.
Conclusões e Implicações Clínicas:
Os resultados demonstram que a regulação precisa de flhDC em Salmonella geneticamente modificada é uma ferramenta poderosa para superar barreiras na terapia oncológica. A capacidade de controlar a expressão de flagelos e promover a entrega intracelular de proteínas terapêuticas, aliada à alta especificidade por tecidos tumorais e metastáticos, posiciona essa estratégia como um avanço significativo.
Além disso, o uso de aspirina como indutor clínico oferece um método seguro, amplamente disponível e de fácil administração para modular o comportamento bacteriano em pacientes. A combinação de segurança, eficácia e especificidade destaca o potencial dessa abordagem no tratamento de cânceres sólidos, incluindo aqueles resistentes a terapias convencionais.